Phản ứng giữa Canxi Clorua và Natri Carbonat | CaCl2 + Na2CO3
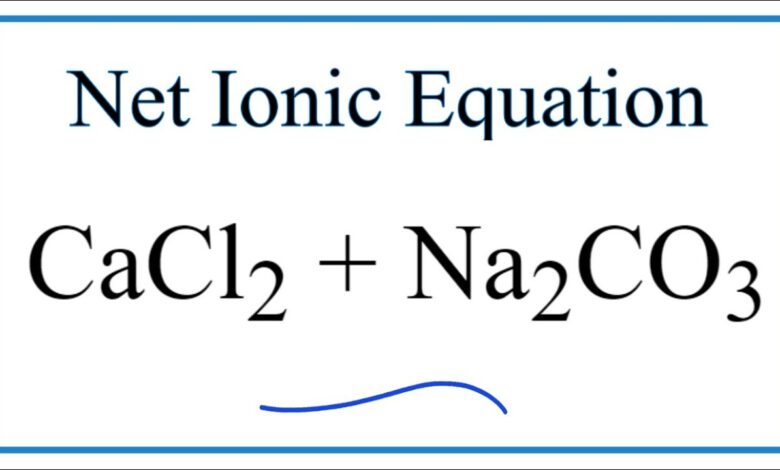
Trong bài viết này, chúng ta sẽ tìm hiểu về phản ứng giữa Canxi Clorua (CaCl2) và Natri Carbonat (Na2CO3), tạo thành Canxi Carbonat (CaCO3) và Natri Clorua (NaCl). Canxi Carbonat là một chất kết tủa trắng không tan trong nước.
Phản ứng giữa CaCl2 và Na2CO3 và phương trình cân bằng
Như đã đề cập trước đó, chúng ta thu được Canxi Carbonat và Natri Clorua như là các sản phẩm của phản ứng. Để tạo ra các sản phẩm này, chúng ta cần sử dụng một pha dung dịch bởi vì các cation và anion cần được phân tách trong nước. Trong trạng thái rắn, các cation và anion không tồn tại.
Cả CaCl2 và Na2CO3 đều tan trong nước và phân li hoàn toàn thành các ion. Trong dung dịch nước, CaCl2 phân li thành các ion Ca2+ và Cl-. Tương tự, Na2CO3 phân li thành các ion Na+ và CO32-.
Phương trình cân bằng của CaCl2 và Na2CO3
CaCl2(aq) + Na2CO3(aq) → CaCO3(s) + 2NaCl(aq)
Khi phản ứng diễn ra, tất cả các chất tham gia và sản phẩm đều ở trạng thái dung dịch. Theo phương trình cân bằng, một mol CaCl2 phản ứng với một mol Na2CO3 và tạo ra một mol CaCO3 và một mol NaCl tương ứng.
Các chất tham gia của phản ứng: CaCl2 và Na2CO3
Canxi Clorua (CaCl2)
Canxi Clorua là một chất rắn màu trắng ở nhiệt độ phòng và tan trong nước tạo thành một dung dịch trong suốt không màu. Khi CaCl2 tan trong nước, nó phân li thành các ion Ca2+ và Cl-.
Natri Carbonat (Na2CO3)
Natri Carbonat là một chất rắn màu trắng và tan trong nước. Dung dịch natri carbonat trong nước không màu và phân li thành các ion Na+ và CO32-.
Các sản phẩm của phản ứng: CaCO3 và NaCl
Canxi Carbonat (CaCO3)
Canxi Carbonat không tan trong nước và kết tủa dưới dạng một chất kết tủa màu trắng.
Natri Clorua (NaCl)
Natri Clorua là một chất rắn màu trắng ở nhiệt độ phòng và tan rất tốt trong nước.
Sự thay đổi số oxi hóa
Số oxi hóa của các nguyên tử không thay đổi trong suốt quá trình phản ứng. Do đó, phản ứng này không phải là một phản ứng oxi-hoá khử.
Quan sát vật lý và hóa học của phản ứng CaCl2 và Na2CO3
Ở đây, chúng ta sẽ nhìn thấy một số quan sát vật lý và thay đổi tính chất hóa học trong suốt quá trình phản ứng.
Thay đổi màu sắc và trạng thái vật lý
- Cả CaCl2 và Na2CO3 đều là các dung dịch không màu.
- Một sản phẩm, CaCO3 là một chất kết tủa màu trắng trong khi sản phẩm còn lại NaCl tồn tại dưới dạng dung dịch. Vì vậy, bạn có thể thấy một chất rắn màu trắng ở đáy dung dịch khi phản ứng kết thúc.
An toàn, nguy hiểm về sức khỏe và tác động môi trường do NaNO2, HCl, HNO2
- CaCl2: Gây kích ứng.
- Na2CO3: Gây kích ứng.
- CaCO3: Gây ăn mòn và kích ứng.
- NaCl: Kích ứng mắt, nếu ăn một lượng lớn có thể gây nguy hiểm.
Câu hỏi
- Bạn được cho 0.01 mol dm-3 dung dịch CaCl2 50 cm3 và 0.01 mol dung dịch Na2CO3 50 cm3. Hai dung dịch này được pha trộn với nhau.
- Viết phương trình cân bằng giữa CaCl2 và Na2CO3.
- Tính số lượng CaCO3 kết tủa trong dung dịch.
- Đề cập đến các giả định bạn đã đưa ra trong quá trình tính toán.
-
Phương trình cân bằng của CaCl2 và Na2CO3
CaCl2(aq) + Na2CO3(aq) → CaCO3(s) + 2NaCl(aq) -
Tính số lượng CaCO3 kết tủa trong dung dịch
Để xác định số lượng CaCO3 được tạo ra, bạn cần tính toán như sau:- Số lượng CaCl2 và Na2CO3 có trong dung dịch: Sử dụng công thức n = CV.
- Số lượng CaCl2 và Na2CO3 phản ứng: Áp dụng phương trình cân bằng theo tỉ lệ.
Số lượng CaCl2
- Số lượng CaCl2 trong dung dịch CaCl2 = 0.01 mol dm-3 50 10-3 dm3 = 0.0005 mol
Số lượng Na2CO3
- Số lượng Na2CO3 trong dung dịch Na2CO3 = 0.01 mol dm-3 50 10-3 dm3 = 0.0005 mol
Các giá trị tính toán được thể hiện trong bảng dưới đây. Theo phương trình cân bằng tỉ lệ, chúng ta có thể xác định số lượng chất tham gia (chất phản ứng) và số lượng sản phẩm được tạo ra.
Vì vậy, toàn bộ CaCl2 và Na2CO3 đều bị tiêu hao trong quá trình phản ứng. Chúng ta có thể tính toán được số lượng CaCO3 kết tủa trong dung dịch.
Số lượng CaCO3
- Số lượng CaCO3 = 0.05 mol * 100 g mol-1 = 5 g
Các hướng dẫn liên quan.