Clo ( Cl ) hóa trị mấy? Nguyên tử khối của Cl – Svnckh.edu.vn
Trong bài viết này viethanbinhduong.edu.vn sẽ chia sẻ chuyên sâu kiến thức của Hóa trị của cl để chia sẻ cho bạn đọc
Clo là chất phi kim có màu vàng lục và mùi của clo vô cùng hắc trong điều kiện thường. Đây là một chất vô cùng độc hại. Clo có vai trò rất quan trọng trong công nghiệp như : Dùng để sát trùng nước khi xử lí nước thải, Tẩy trắng sợi, giấy, vải, Là nguyên liệu để sản xuất nhiều hợp chất vô cơ và hữu cơ. Sản phẩm hữu cơ chứa clo có ý nghĩa to lớn trong công nghiêp.Vậy Clo hóa trị mấy? nguyên tử khối Clo là bao nhiêu và cách tính phân tử khối của Cl2 như thế nào thì dưới bài viết này chúng ta cùng nhau đi tìm hiểu nhé.
Clo ( Cl ) hóa trị mấy? Nguyên tử khối của Cl:
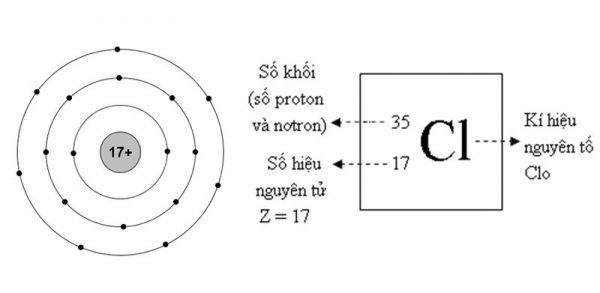
– Ký hiệu hóa học: Cl.
– Nguyên tử khối: 35,45 g/mol (thường lấy là 35,5 g/mol).
– Clo (Cl2) có hóa trị I
– Số đơn vị điện tích hạt nhân: Z = 17.
– Độ âm điện: 3,16.
– Số oxi hóa: -1; 0; +1; +3; +5; +7.
– Cấu hình: 1s22s22p63s23p5 hay [Ne] 3s23p5.
=> Vị trí: ô số 17; chu kỳ 3; nhóm VIIA.
– Bán kính nguyên tử (nm): 0,99.
– Có 7e lớp ngoài cùng → cấu hình e lớp ngoài cùng là ns2np5 -> .
- NO3 hóa trị mấy? Cấu tạo phân tử NO3 chuẩn
- Lưu huỳnh ( S ) có mấy hóa trị, nguyên tử khối của S
- Photpho ( P ) hóa trị mấy? ứng dụng và tính chất của P
– Ở trạng thái cơ bản, Clo chỉ thiếu 1 e đạt cấu hình e bền vững của khí hiếm => dễ dàng nhận 1e để tạo thành ion âm Cl‑ hoặc tạo 1 liên kết CHT với 1 nguyên tử Cl khác tạo Cl2.
– Đơn chất của Clo tồn tại ở dạng phân tử do 2 nguyên tử Cl kết hợp với nhau bằng liên kết CHT tạo thành (Cl2).
– Trong các hợp chất, Clo có các số oxi hóa là -1; 0; +1; +3; +5; +7 (vì Clo còn có phân lớp 3d trống nên khi được kích thích thì 1e, 2e hoặc 3e sẽ nhảy sang phân lớp d để tạo thành 3; 5 hoặc 7e độc thân nên Clo có các số oxi hóa dương).
Trạng thái tự nhiên và tính chất vật lí
1. Trạng thái tự nhiên
– Clo tồn tại ở dạng hợp chất: Chủ yếu ở dạng muối clorua, quan trọng nhất là NaCl. NaCl có trong nước biển và đại dương. NaCl được tìm thấy ở trạng thái rắn gọi là muoosimor. KCl cũng khá phổ biến, nó có trong khoáng vật cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
2. Tính chất vật lí
– Clo là chất khí, màu vàng lục, mùi xốc, nặng hơn không khí.
– Khí clo tan vừa phải trong nước tạo thành nước clo có màu vàng nhạt. Clo tan nhiều trong các dung môi hữu cơ.
* Lưu ý: Khí clo độc.
Clo rất có hại cho sức khỏe con người. Clo bất luận ở dạng khí hay lỏng cũng có thể là nguyên nhân gây tổn thương vĩnh viễn, đặc biệt hơn là có thể gây tử vong. Nhìn chung sự tổn thương vĩnh viễn xảy ra là do hơi của khí Clo. Clo tiềm ẩn của sự xuất hiện bệnh về cổ họng, mũi và đường hô hấp (đường thực quản gần phổi). Hậu quả nghiêm trọng trong giai đoạn ngắn:

– Ảnh hưởng của mật độ 250ppm cho 30 phút có thể gây tử vong cho người lớn
– Sự kích thích cao xuất hiện khí, khi hít vào có thể làm bỏng da và mắt.
Hậu quả của bệnh mãn tính sẽ phần nào gây chết người trong thời gian dài: Đối với tác động lâu dài của khí Clo, sẽ làm cho người ta trở nên già trước tuổi, gây ra những vấn đề về phế quản, sự ăn mòn của răng, các bệnh lien quan đến phổi như lao và khí thũng.
. Tính chất hóa học:
Có độ âm điện lớn: + Trong hợp chất với F, O: Cl2 có số OXH dương (+1; +3; +5; +7). + Trong hợp chất với các nguyên tố còn lại: Cl2 có số OXH -1.
Clo là 1 phi kim hoạt động: + Thể hiện tính oxi hóa mạnh. (trong phản ứng với H2 và kim loại)
+ Thể hiện tính khử (trong 1 số trường hợp như với Nước; dung dịch kiềm…)
1. Oxi hóa hầu hết các kim loại → muối clorua -> (phản ứng tỏa nhiệt)
Cl2 + kim loại → muối clorua
VD: 3Cl2 + 2Al → 2AlCl3 (nhôm clorua)
2Na + Cl2 → 2NaCl (natri clorua)
Cu + Cl2 → CuCl2 (đồng (II) clorua)
2Fe + 3Cl2 → 2FeCl3 (sắt (III) clorua)
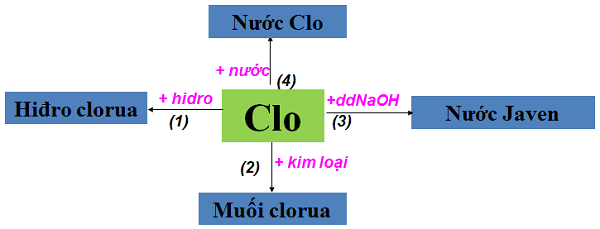
2. Tác dụng với H2 (đk: to, ánh sáng)
Dạng khí: hiđro Clorua
Dạng dung dịch: axit clohiđric (axit mạnh, mạnh hơn axit HCl)
Chú ý: hỗn hợp nổ mạnh nhất khi Cl2 : H2 = 1:1. 3. Tác dụng với nước → axit Clohiđric HCl + axit hipoclorơ HClO:
Cl2 + H2O ⇌ HCl + HClO (chất oxi hóa mạnh)
-> (hỗn hợp HCl, HClO là nước clo → có tính tẩy màu)
Cl2 + 2NaOH → NaCl + NaClO + H2O
-> (hỗn hợp NaCl, NaClO là nước gia ven → có tính tẩy màu)
→ Trong 2 phản ứng này Cl2 vừa thể hiện tính khử, vừa thể hiện tính OXH.
4. Tác dụng với muối của halogen khác (NaBr, NaI):
– Không OXH được ion F- → F2
– OXH được ion Br- → Br2 và ion I- → I2
=> để chứng minh tính OXH của Cl2 mạnh hơn Br2 và I2.
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
5. Tác dụng với chất khử khác (SO2; FeCl2…):
SO2 + Cl2 + 2H2O → H2SO4 + 2HCl
Cl2 + 2FeCl2 → 2FeCl3
Phương pháp giải bài tập tính phân tử khối Cl2
Cách tính phân tử khối :
Phân tử khối là tổng số lượng nguyên tử khối của các nguyên tử tạo thành phân tử.
Bước 1: Dựa vào kí hiệu hóa học, Xác định được nguyên tử khối của mỗi nguyên tử
Bước 2: Nhân nguyên tử khối với số nguyên tử của nguyên tố đó
Bước 3 : Cộng các tích của các nguyên tố với nhau.

. Điều chế
a. Trong phòng thí nghiệm
– Cho HCl tác dụng với chất oxi hóa mạnh (thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3).
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
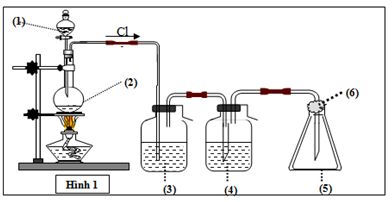
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
KClO3 + 6HCl → 3H2O + KCl + 3Cl2
b. Trong công nghiệp
– Điện phân nóng chảy:
2NaCl → 2Na + Cl2
– Điện phân dung dịch muối halogenua của kim loại kiềm có màng ngăn:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
Xem thêm bảng hóa trị và hóa trị của các nguyên tố:
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
CO3 hóa trị mấy? Phân tử khối và Cách nhận biết ion CO3
Kẽm ( Zn ) hóa trị mấy? tính chất hóa học và vai trò của Zn
SO4 hóa trị mấy? Công thức kim loại M với nhóm SO4
Bạc ( Ag ) hóa trị mấy? Cấu tạo của nguyên tử và tính chất của Ag

