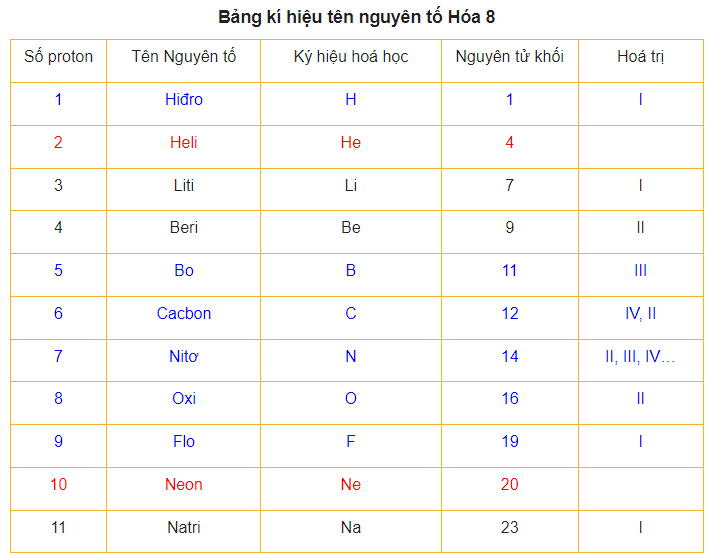
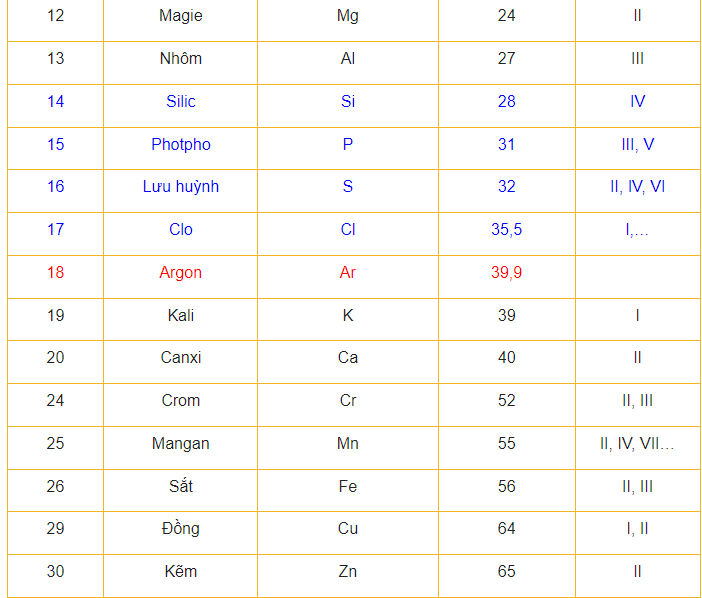
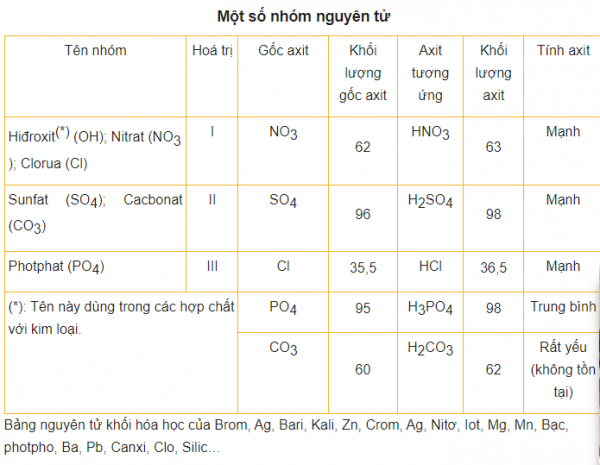
Nguyên Tử Khối Hóa Học – Bảng Nguyên Tử Khối và Mẹo Học
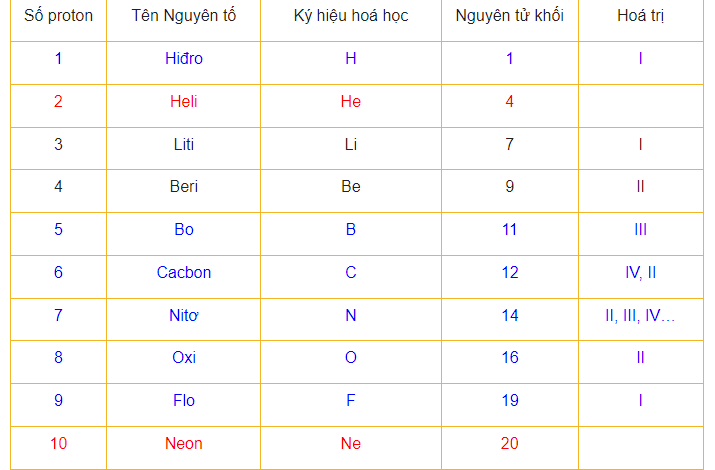
Chào bạn! Khi bước vào lớp 8, bạn sẽ được làm quen với khái niệm “nguyên tử khối” và “bảng nguyên tử khối hóa học”. Bên cạnh những kiến thức cơ bản khác như bảng hóa trị, bảng nguyên tử khối hóa học sẽ trở thành người bạn đồng hành suốt quá trình học môn hóa, giúp bạn giải quyết các bài tập khó một cách nhanh chóng nhất. Bạn có biết rằng nguyên tử của các nguyên tố khác nhau có kích thước và khối lượng khác nhau?
Định Nghĩa về Nguyên Tử Khối
1. Nguyên Tử Khối là gì?
Nguyên tử khối là khối lượng của một nguyên tử cụ thể được tính bằng đơn vị “Cacbon” (đvC). Các nguyên tố khác nhau có chỉ số nguyên tử khối khác nhau và khối lượng chỉ là khối lượng tương đối.
Ví dụ: Khối lượng (nguyên tử khối) của Hidro (H) là 1 (đvC), của Neon (Ne) là 20 (đvC).
Nguyên tử khối của một nguyên tử chính là khối lượng tương đối của nguyên tử đó. Nó được tính bằng tổng khối lượng các proton, electron và neutron trong nguyên tử. Tuy nhiên, vì khối lượng của electron thường rất nhỏ, nên không được tính vào. Do đó, khối lượng của nguyên tử chủ yếu dựa trên khối lượng của hạt nhân.
Nguyên tử khối cũng có thể hiểu là khối lượng tính theo đơn vị gam của 1 mol nguyên tử. Trong hệ quốc tế về đo lường, nó được ký hiệu bằng chữ “u”.
1 u = 1/NA gam = 1/(1000 NA) kg
(Với NA là hằng số Avogadro)
1 u ≈ 1.66053886 x 10-27 kg
1 u ≈ 1.6605 x 10-24 g
2. Đơn Vị Cacbon là gì?
Đơn vị Cacbon (đvC) là đơn vị mặc định được sử dụng để đo khối lượng của các nguyên tử. Đơn vị này tương ứng với 1/12 khối lượng của hạt nhân của nguyên tử Cacbon-12.
Trong quá khứ, các nhà khoa học đã sử dụng Hydro hoặc Oxi làm đơn vị tiêu chuẩn. Tuy nhiên, đến năm 1961, Viện Đo Lường Quốc Tế đã chọn Cacbon là đơn vị đo lường chính bởi vì sự phổ biến của đồng vị Cacbon-12 trong tự nhiên và độ sai số rất thấp.
3. Nguyên Tử Khối Trung Bình
Hầu hết các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định. Do đó, nguyên tử khối của các nguyên tố có nhiều đồng vị được tính bằng cách lấy trọng số trung bình của các đồng vị dựa trên tỉ lệ phần trăm số nguyên tử tương ứng.
Giả sử nguyên tố X có 2 đồng vị A và B, với các kí hiệu A và B cũng là nguyên tử khối của 2 đồng vị và tỉ lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó, nguyên tử khối trung bình (được ký hiệu bar{A}) của nguyên tố X được tính bằng công thức:
bar{A} = frac{aA+bB}{100}
Trong những phép toán không đòi hỏi độ chính xác cao, ta có thể coi nguyên tử khối bằng số khối.
Đó là một số kiến thức cơ bản về nguyên tử khối và bảng nguyên tử khối hóa học. Tuy nhiên, để học thật tốt, bạn cần luyện tập và ôn lại thường xuyên. Dưới đây là một số mẹo học nhanh để bạn thuộc lòng bảng nguyên tử khối hóa học:
Mẹo Học Nhanh:
1. Thường xuyên làm bài tập hóa học
Phương pháp này là tối ưu để ghi nhớ bảng nguyên tử khối hóa học nhanh chóng. Sau khi hiểu được cốt lõi nội dung, bạn sẽ dễ dàng ghi nhớ công thức. Hãy luyện tập thường xuyên và ôn lại đều đặn để tránh quên.
2. Học qua bài ca nguyên tử khối
Khi có những bài ca về nguyên tử khối hóa học, việc học và ghi nhớ sẽ dễ dàng hơn bao giờ hết. Dưới đây là hai bài ca về nguyên tử khối dễ nhớ nhất:
Bài Tập về Nguyên Tử Khối:
Bài 1:
Nguyên tử X nặng gấp hai lần nguyên tử Nitơ. Hãy tính nguyên tử khối và cho biết X thuộc nguyên tố nào? Viết kí hiệu hóa học của nguyên tố đó.
Hướng dẫn giải:
Nguyên tử khối của nguyên tử Nitơ là 14 đvC. Vì nguyên tử X nặng gấp 2 lần nguyên tử Nitơ, ta có:
Nguyên tử khối của X = 14 x 2 = 28 (đvC)
Nguyên tử X là nguyên tố Silic, kí hiệu là Si.
Bài 2:
Hãy so sánh nguyên tử magie nặng hay nhẹ hơn bao nhiêu lần so với:
a) Nguyên tử Cacbon
b) Nguyên tử Lưu huỳnh
c) Nguyên tử Nhôm
Hướng dẫn giải:
Để làm bài tập này, chúng ta cần xác định nguyên tử khối của các nguyên tử Magie (Mg), Cacbon (C), Lưu huỳnh (S) và Nhôm (Al) dựa trên bảng nguyên tử khối.
a) Nguyên tử khối của Mg = 24; nguyên tử khối của C = 12
⇒ Nguyên tử Mg nặng hơn nguyên tử C 24/12 = 2 lần.
b) Nguyên tử khối của Mg = 24; nguyên tử khối của S = 32
⇒ Nguyên tử Mg nhẹ hơn nguyên tử S 24/32 = 0,75 lần.
c) Nguyên tử khối của Mg = 24, nguyên tử khối của Al = 27
⇒ Nguyên tử Mg nhẹ hơn nguyên tử Al 24/27 = 8/9 lần.
Vậy đó là một số kiến thức cơ bản về nguyên tử khối và bảng nguyên tử khối hóa học. Để học tốt hơn, hãy luyện tập thường xuyên và áp dụng các mẹo học trên. Trường Trung Cấp Việt Hàn (VKI) là một địa chỉ uy tín để bạn tìm hiểu thêm về chương trình học cũng như các khóa học có liên quan.