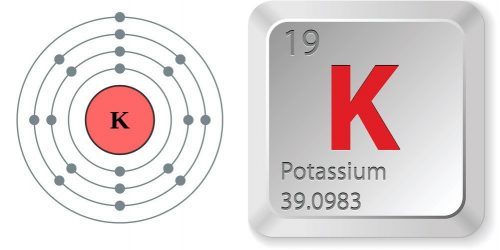
Nguyên tử khối của Kali và hóa trị của Kali

Bạn có biết nguyên tử khối của Kali là bao nhiêu không? Và Kali có hóa trị mấy? Trong bài viết này, chúng ta sẽ cùng tìm hiểu về những thông tin này.
Đặc điểm chung của Kali và Natri
Kali và natri là hai nguyên tố có tính chất hóa học rất giống nhau. Cả hai đều thuộc nhóm IA trong bảng tuần hoàn và có cùng mức năng lượng ion hóa thứ nhất. Khi được kích hoạt, nguyên tử của cả hai sẽ cho đi electron ngoài cùng duy nhất. Mặc dù là hai nguyên tố khác nhau, nhưng kali và natri có thể kết hợp với những anion giống nhau để tạo nên những muối có tính chất tương tự. Điều này khiến cho việc tìm hiểu về Kali trở nên thú vị và quan trọng.
Nguyên tử khối của Kali
Nguyên tử khối của Kali là 39. Kali có vị trí trong bảng tuần hoàn ở nhóm IA, có số proton là 19. Kali cũng có cấu hình electron là [Ar] 4s1. Khối lượng nguyên tử của Kali là 39 g/mol và có số hiệu nguyên tử là 19. Ngoài ra, Kali còn có ba đồng vị là 39K, 40K và 41K.
Tính chất vật lí của Kali
- Kali là kim loại nhẹ thứ hai sau liti, có màu trắng bạc và rất mềm. Kali có khối lượng riêng là 0.863 g/cm3 và có điểm nóng chảy là 63.5oC. Điểm sôi của Kali ở áp suất 760 là 760oC.
Tính chất hóa học của Kali
Kali có tính khử rất mạnh. Kali có khả năng tác dụng với các phi kim như oxi và clo để tạo thành oxit kali (K2O) và clorua kali (KCl) tương ứng. Khi bị ôxi hóa, kali cháy tạo ra ngọn lửa màu tím đặc trưng.
Kali cũng có khả năng tác dụng với axit để tạo thành muối kali và giải phóng khí hidro (H2) tự do. Ngoài ra, kali còn tác dụng mạnh với nước để tạo thành dung dịch kiềm kali (KOH) và khí hidro (H2). Kali cũng có thể tác dụng với hidro để tạo thành kali hidrua (KH).
Ứng dụng của Kali
Kali có nhiều ứng dụng trong cuộc sống hàng ngày. Các loại phân hóa học chứa kali như clorua kali, sulfat kali, cacbonat kali, v.v. được sử dụng trong nhiều lĩnh vực khác nhau. Ngoài ra, kali còn được sử dụng trong sản xuất thủy tinh, làm chất truyền nhiệt trung gian, cung cấp chất cần thiết cho cây trồng và nhiều ứng dụng khác.
Để biết thêm thông tin về hóa trị và tính chất của các nguyên tố khác, bạn có thể tham khảo bảng hóa trị lớp 8 và các bài viết liên quan trên trang web của Trường Trung Cấp Việt Hàn (VKI).